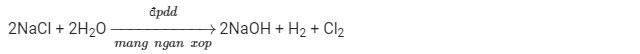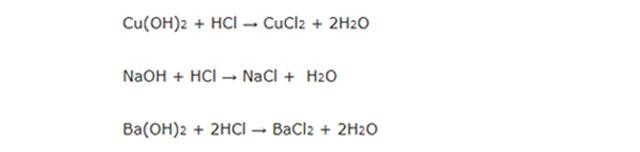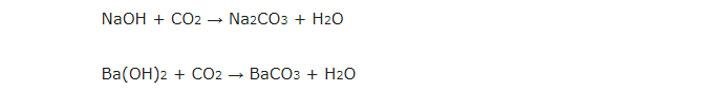Oxit bazo là gì? Tính chất hóa học của bazo, bài tập áp dụng
Bazo là một nhóm hóa chất được sử dụng phổ biến nhằm chứng minh, giải thích cho nhiều vấn đề trong hóa học và ứng dụng phổ biến trong đời sống cũng như sản xuất công nghiệp. Trong bài viết này, chúng ta cùng tìm hiểu oxit bazo là gì? Tính chất hóa học của bazo,… để áp dụng giải một số bài toán liên quan đến kiến thức về bazơ.
Tóm tắt
Khái niệm bazo – Oxit bazo là gì?
Bazơ là hợp chất hóa học mà phân tử của nó chứa một nguyên tử kim loại (VD: Na, Al, Ca,…) liên kết với một hoặc nhiều nhóm Hidroxit (OH). Trong đó, hóa trị của kim loại chính bằng số nhóm hidroxit. Đơn giản hơn, bazo là một chất mà khi hòa tan nó trong nước sẽ tạo ra dung dịch có độ pH > 7.

Công thức của bazo là gì?
Bazo có công thức: M(OH)n
Trong đó: M: một kim loại
n: hóa trị của kim loại
Bazo có mấy loại?
Người ta chia bazơ thành 2 loại chính dựa vào tính tan của bazo trong nước. Hai loại gồm:
- Bazo tan trong nước, ví dụ: Ba(OH)2, Sr(OH)2, LiOH, NaOH,…
Các bazo này khi hòa tan trong nước tạo thành dung dịch bazo, gọi là kiềm.
- Bazo không tan được trong nước như: Cu(OH)2, Fe(OH)2, Al(OH)3, Mg(OH)2,…
Oxit bazo là gì?
Oxit bazơ là hợp chất bao gồm một hay nhiều nguyên tử kim loại liên kết với một hoặc nhiều nguyên tử Oxi có bazo tương ứng. Một số oxit bazo tan được trong nước chứa các kim loại kiểm ví dụ: Na, K, Li,… và các kim loại kiềm thổ như: Ba, Ca, Mg,…(trừ Be).
Ví dụ: Na2O bao gồm bazơ NaOH
Cu2O bao gồm bazơ Cu(OH)2
Cách phân biệt oxit bazơ và oxit axit

Tính chất hóa học của bazo
– Bazo tác dụng với chất chỉ thị màu
Quỳ tím sẽ chuyển xanh khi nhúng quỳ tím vào dung dịch bazo.
Dung dịch bazo làm phenolphatalein từ không màu chuyển thành màu đỏ.
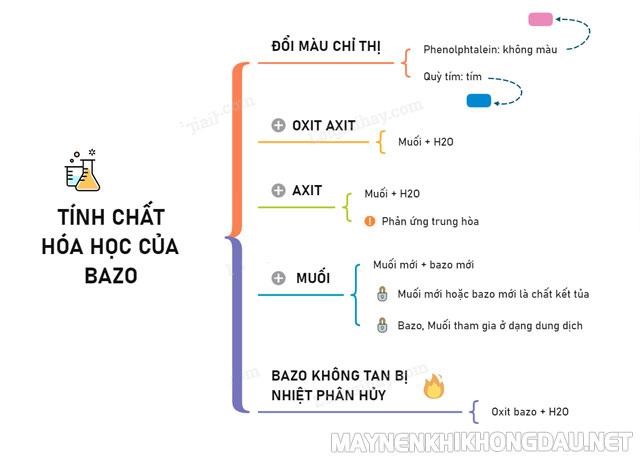
– Bazo tác dụng với Axit
PTPƯ: Bazo + Axit → Muối + H2O
Bazơ (cả bazo tan và bazo không tan) khi tác dụng với Axit sẽ tạo ra sản phẩm là muối và nước.
VD: KOH + H2SO4 → K2SO4
Cu(OH)2 + 2HNO3→ Cu(NO3)2 + H2O
– Bazo tác dụng với Oxit axit
PTPƯ: Bazo + Oxit axit → Muối + H2O
Ví dụ:
- 3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ trắng + 3H2O
- Ba(OH)2 + CO2 → BaCO3↓ trắng + H2O
– Bazo tác dụng với muối
Dung dịch bazo khi tác dụng với dung dịch muối sẽ tạo ra sản phẩm là bazo mới và muối mới.
Ví dụ: 6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3
– Bazo không tan bị nhiệt phân hủy
Bazơ không tan khi bị nhiệt phân hủy sẽ tạo ra sản phẩm là oxit và nước.
Ví dụ: Fe(OH)2 (to) → FeO + H2O
Một số bazơ quan trọng
Natri Hidroxit (NaOH)
Natri Hidroxit, ký hiệu: NaOH là chất rắn không màu, hút ẩm mạnh, tan nhanh trong nước và tỏa nhiệt.
NaOH mang tính chất đầy đủ của một bazo không tan:
- Làm chuyển màu quỳ tím sang xanh và phenolphtalein từ không màu sang màu đỏ.
- Ttác dụng với nước tạo ra sản phẩm là muối và nước.
PTPƯ: NaOH + HCl → NaCl+ H2O
- Tác dụng với Oxit axit tạo ra sản phẩm muối và nước.
PTPƯ: 2NaOH + CO2 → Na2CO3 + H2O
- Tác dụng với dung dịch muối tạo ra sản phẩm gồm muối mới và bazo mới.
PTPƯ: 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl

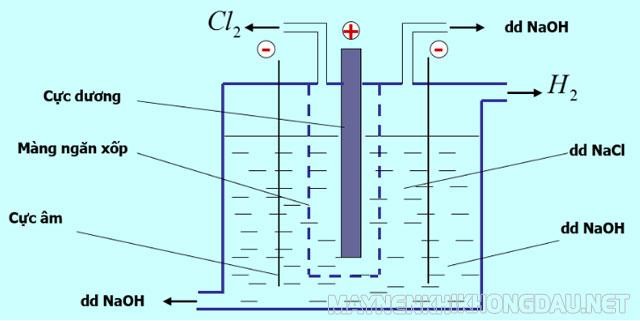
PT điện phân:
Màng ngăn xốp nhằm ngăn khí clo thoát ra vì clo phản ứng với NaOH theo PT:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Canxi Hidroxit (Ca(OH)2)
Ca(OH)2 rất ít tan trong nước và một phần nó hòa tan được trong nước thì được gọi là nước vôi trong. Canxi Hidroxit là một bazo tan vì vậy nó mang tính chất đầy đủ của một bazơ tan:
- Làm quỳ tím chuyển xanh và phenolphtalein không màu chuyển sang màu đỏ.
- Tác dụng với axit tạo ra sản phẩm gồm muối và nước.
PTPƯ: Ca(OH)2 + CO2 → CaCO3 + H2O
- Tác dụng với oxit axit tạo ra sản phẩm muối và nước.
PTPƯ: Ca(OH)2 + 2HCl → CaCl2 + H2O
- Tác dụng với dung dịch muối tạo ra sản phẩm gồm muối mới và bazo mới.
PTPƯ: Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
Canxi Hidroxit (Ca(OH)2) được ứng dụng chủ yếu vào việc xử lý, khử độc chất thải sinh hoạt, chất thải công nghiệp; khử chua đất trồng trọt và được dùng làm vật liệu xây dựng,…
Bài tập áp dụng kiến thức về bazo, oxit bazo
Bài tập 1:
- Tất cả các chất kiềm đều là bazo đúng hay sai? Hãy minh họa bằng cách đưa ra 3 ví dụ về công thức hóa học của 3 chất kiềm đó.
- Tất cả các bazo đều là chất kiểm đúng hay sai? Hãy minh họa bằng cách đưa ra 3 ví dụ về công thức hóa học của 3 chất kiềm đó.
Hướng dẫn làm:
a) Tất cả các chất kiểm đều là bazo là đúng. Vì, tất cả các chất kiềm đều tan được trong nước vậy nên tất cả các chất kiềm đều là bazo.Ví dụ: Ba(OH)2, Sr(OH) , LiOH
b) Tất cả các bazo đều là chất kiềm là sai. Vì, vẫn có những bazo không tan trong nước nên những bazo này không phải là chất kiềm.
Ví dụ: Cu(OH)2, Fe(OH)2, Al(OH)3
Bài tập 2: Dựa vào những bazo cho trước: Cu(OH)2, NaOH, Ba(OH)2 hãy xác định những bazo nào:
- Tạo ra phản ứng với dung dịch HCl
- Bị nhiệt phân hủy
- Tác dụng được với oxit axit CO2
- Làm quỳ tím chuyển xanh
Hướng dẫn làm:
- Cu(OH)2, NaOH, Ba(OH)2 đều tác dụng và tạo ra phản ứng với dung dịch HCl.
- Bazo không tan sẽ bị nhiệt phân hủy. Vậy chỉ có Cu(OH)2
- NaOH, Ba(OH)2 là 2 bazo tác dụng được với CO2
- NaOH, Ba(OH)2 là những bazo chuyển màu quỳ tím thành xanh.
Bài tập 3: Hãy viết các phương trình hóa học để điều chế các dung dịch bazo từ những chất cho sẵn gồm: H2O, Na2O, CaO.
Hướng dẫn làm:
Từ 3 chất cho sẵn, để điều chế thành các dung dịch bazo ta có các phương trình hóa học sau:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Với những kiến thức tổng hợp về bazơ trong bài viết trên, maynenkhikhongdau.net hy vọng bạn đã hiểu chi tiết hơn oxit bazo là gì cũng như những tính chất hóa học của bazơ để có thể áp dụng giải mọi bài toán liên quan đến phần kiến thức hóa học này.